原标题:科研 Food Funct:羊奶和牛奶对阿莫西林致肠道菌群失调的大鼠微生物区系组成和发酵产物的影响不同
抗生素是治疗细菌感染的有效方法,然而,口服抗生素可能会改变肠道微生物区系的组成。在本研究中,我们检测了抗生素对肠道菌群失调的影响,然后评估了牛奶和羊奶恢复新断奶大鼠肠道微生物区系组成和代谢的潜力。在第一项研究 (肠道生物失调模型) 中,大鼠接受阿莫西林治疗;阿莫西林是抗生素 (氨苄青霉素、庆大霉素和甲硝唑) 的混合物治疗;以及不使用抗生素 (对照组) 治疗。与对照组相比,抗生素降低了大鼠的体重、食物摄入量和排泄量。细菌 (双歧杆菌、乳酸菌及总细菌) 和短链脂肪酸 (SCFAs)在大鼠盲肠、结肠和粪便中乙酸、丁酸和丙酸的浓度显著受抗生素处理的影响。在第二项研究中,我们研究了牛奶和羊奶对阿莫西林诱导的肠道菌群失调大鼠的细菌数量和代谢的恢复作用。羊奶能显著增加双歧杆菌和乳杆菌属的数量,降低阿莫西林组大鼠盲肠和结肠中产气荚膜梭菌的数量。而喂养牛奶的大鼠肠道中乳酸杆菌含量较高,产气荚膜梭菌含量较低。奶牛和羊奶饲粮中盲肠和结肠短链脂肪酸 (乙酸、丁酸和丙酸) 浓度差异显著。总的来说,在抗生素诱导的大鼠模型中,羊奶和牛奶对未成熟肠道的影响是不同的。
肠道微生物区系对健康很重要,现在越来越清楚的是,一个健康的婴儿肠道微生物区系是一个人未来健康的重要决定因素。在生命的前三年,肠道微生物区系的丰度、组成和多样性经历了快速而巨大的变化。研究表明,肠道微生物区系对宿主生理有深远的影响,在健康和疾病中起着至关重要的作用。抗生素诱导的新生儿和儿童早期肠道微生物区系组成的变化在以后的生活中似乎有持久的负面影响。微生物区系和宿主之间的联系中断会导致肠道菌群失调,这与哮喘、炎症性肠病、肥胖及糖尿病等新陈代谢障碍有关。动物研究表明,抗生素通过破坏肠道微生物区系的组成和新陈代谢而导致肠道菌群失调。抗生素的抗菌活性差异很大,有些针对特定的细菌群体,如革兰氏阳性或革兰氏阴性微生物,而另一些针对广泛的细菌种类,既有革兰氏阳性微生物,也有革兰氏阴性微生物。虽然一些抗生素表现出广谱活性,但没有单独的抗生素影响肠道内的所有细菌组成。在以前的小动物研究中,混合抗生素被用来破坏肠道微生物区系组成的平衡,影响到广泛的细菌物种。使用单一抗生素治疗已证明破坏肠道微生物区系组成,导致抑制细菌发酵产物,如短链脂肪酸(SCFA)的产生。然而,就其严重程度而言,还没有达成一致的标准来定义肠道菌群失调。在本研究中,我们的目的是利用新断奶的大鼠建立肠道菌群失调的动物模型。我们检验了单一常用口服抗生素 (阿莫西林) 与混合抗生素治疗在诱导肠道菌群失调方面的有效性。用新断奶的雄性SD大鼠作为人类婴儿的动物模型,阿莫西林是婴幼儿最常用的抗生素,在本研究中用于诱导肠道菌群失调。第二种抗生素治疗,氨苄青霉素、庆大霉素和甲硝唑的混合物也被评估。这种抗生素组合可能对肠道中的几种微生物具有广谱活性。检查的肠道健康生物标志物是细菌数量、有机酸和肠道形态测量。然后,我们使用已建立的大鼠生物失调模型来研究羊奶和牛奶在恢复肠道细菌数量和新陈代谢方面的潜力。我们假设,与牛奶相比,饲喂羊奶2周对抗生素 (阿莫西林) 诱导的肠道菌群失调的恢复没有影响, 对抗生素 (阿莫西林) 所致肠道菌群失调的保护作用无明显差异在抗生素治疗前用羊奶和牛奶喂养3周。
1动物研究动物实验程序 (申请号13948和14746) 由农业研究草原动物伦理委员会 (新西兰北部帕默斯顿) 根据新西兰1999年动物福利法案批准。SD大鼠饲养在温度22±1℃,湿度60±5%,每小时换气12次,光/暗周期12 h的房间里。在整个研究过程中,所有的大鼠都被给予饮食和水。这些饮食是以干粉的形式提供的,装在玻璃瓶里,放在一个陶器碗里以最大限度地减少溢出和浪费。抗生素诱导的肠道菌群失调大鼠模型的实验饲料组成,以及评价牛奶和羊奶饲料对阿莫西林诱导的肠道菌群失调的影响,分别见于ESI表S1、S2。2抗生素诱导的大鼠生物失调模型
21日龄断奶雄性大鼠(体重约50 g)被关在单独的笼子里,随机分为对照组、阿莫西林组和抗生素混合物组(n=6),分别用各自的抗生素治疗7 d或14 d (ESI图S1)。阿莫西林组饮水中加入阿莫西林 (1 gL-1)。抗生素混合组大鼠饮水中加入氨苄青霉素 (1 gL-1)、庆大霉素 (0.1 gL-1) 和甲硝唑 (1 gL-1)。对照组大鼠不接受抗生素治疗。在先前研究基础上选择添加到饮用水中的抗生素浓度。每隔7 d记录每只大鼠的摄食量和体重。在抗生素治疗7 d或14 d后,大鼠被过量二氧化碳安乐死。拍摄肠道照片,测量十二指肠到结肠的长度,切除盲肠称重。随后取出盲肠和结肠中的消化液,并将其储存在-80°C下进行细菌定量和有机酸分析。第7 d和第14 d采集的粪便样本也保存在-80°C进行细菌定量和有机酸分析。
将60只21日龄断奶雄性大鼠(活重约50 g),随机分成6组(n=10):山羊奶(不加抗生素)、牛奶(不加抗生素)、山羊奶(加抗生素) 8-14 d、牛奶(加抗生素) 8-14 d、山羊奶(加抗生素) 22-28 d和牛奶(加抗生素) 22-28 d (ESI图S2)。山羊奶和牛奶此后分别被称为羊奶和牛奶。牛奶是以粉末饲料的形式提供的,所有的老鼠都可以喝到水。研究中使用的抗生素是阿莫西林。经过7 d的适应期后,在第2周或第4周,阿莫西林每天口服,给药时间7 d,剂量为50 mg kg-1。未用抗生素组大鼠每天口服水 (对照组),每组大鼠口服阿莫西林50 mg kg-1 共7 d。每隔7 d记录每只大鼠的摄食量和体重。每天收集每只大鼠的粪便,按周等份储存,称量后储存于-80°C。28 d喂养结束后,过量CO2处死大鼠,测量肠道长度 (十二指肠至结肠),取盲肠称重。盲肠和结肠的消化液收集并保存在−80°C,直到细菌定量和有机酸分析。
5有机酸定量采用气相色谱法 (GC) 测定有机酸浓度。将盲肠、结肠和粪便样品称重到15 mL EP管中,用0.01 M含2-乙基丁酸 (5.56 mM) 的磷酸缓冲盐水 (1:9) 稀释作为内标。在3000 g离心5分钟 (4°C) 之前让样品在冰上轻微融化并涡旋成浆液。用250 µL浓盐酸和1000 µL乙醚对500 µL的上清液进行酸化处理。进一步涡旋后,为了使酸转移到乙醚相,样品在10000 g下离心5分钟 (4℃) 。二乙醚相储存在-80℃冰箱中,直到实验开始。在加盖的GC瓶中,用20 µL的N-tert-butyldimethylsilyl-N-methyltrifluoroacetamide和1%的叔丁基二甲基氯硅烷在水浴中加热至80°C 20分钟,衍生化100 µL的二乙醚相。为了实现完全衍生化,样品在室温下放置48小时后进行分析。以2-乙基丁酸 (5 mM) 为内标,与样品一起制备衍生化标准品。分析采用气相色谱仪系统,配备有火焰电离检测器和Restek柱。载气为氦气,总流量21.2 mL min−1,压力131.2kPa,补充气体是氮。温度程序从70°C开始,在6°C min−1增加到115°C,最终在60°C min-1增加到300°C,保持3分钟。流量控制模式设置为线速度。进样器温度260°C,检测器温度310°C。样品 (1µL) 采用分流进样 (分流比为10:1) 。使用岛津GC工作站Lab SolutionsVersion 5.87对气相色谱仪进行控制和数据处理。盲肠、结肠和粪便中有机酸的定量见ESI表S4。6统计分析
对于每周记录的数据(体重、食物摄入量和粪便排泄量) ,拟合了混合效应模型,测试了处理、时间和它们的相互作用(固定效应)对动物之间和动物内部变化的影响(拟合了动物的随机效应以及残差变化)。混合效应模型类似于重复测量方差分析(ANOVA),但可以容纳这样一个事实,即一些动物只有1周的饮食数据,而其他动物有2周的数据,而不试图估计未观察到的数据。
对于只在试验结束时记录的数据 (细菌、有机酸、盲肠重量和肠道长度) ,采用双因素方差检验处理、时间及其相互作用的影响。后处理采用Fisher最小显著性差异 (LSD) 检验。
LOD以下的有机酸值被LOD代替进行方差分析。这适用于只有少数动物的LOD值低于此值的情况。当几个处理中的所有动物都没有可量化的酸量时,方差分析是不合适的,并使用非参数检验 (Kruskal-Wallis非参数方差分析) 来比较实验组。为了帮助解释结果,对于混合模型和方差分析,计算了LSDs。采用Conover-Iman方法比较Kruskal-Wallis检验后的中位数。对所有模型都进行了残差检查,以确保模型的假设得到满足,必要时,将数据转换以供分析。P<0.05为差异有统计学意义。
主成分分析(PCA)被用来展现细菌和有机酸数据,显示哪些样品彼此相似,哪些测量结果相关。在这两种情况下,分析都是在对数上对数据的方差-协方差矩阵进行的,因此代表了数据的大比例变化。所有分析均采用GenStat进行。
1抗生素诱导的大鼠生物失调模型1.1大鼠体重、食物摄入量和粪便排泄量与对照组和阿莫西林组相比,抗生素混合物组大鼠在第7 d和第14 d的体重和摄食量显著降低 (P <0.001)(ESI图S3和S4)。当通过调整体重的食物摄入量来考虑减轻的体重时,抗生素混合组的大鼠在初始习服期末的食物摄入量较低 (ESI图S5)。与阿莫西林对照组和阿莫西林组相比,抗生素混合物组大鼠的摄食量明显减少 (P<0.001),而阿莫西林组大鼠的摄食量明显减少 (P<0.05)。14 d后,经体重调整后的摄食量在抗生素组 (阿莫西林和抗生素混合物) 之间相似,但抗生素混合物组与对照组相比有显著性差异 (P <0.001)。根据食物摄入数据,抗生素治疗也影响大鼠粪便排泄量(ESI图S6)。在处理7 d和14 d后,抗生素合剂组的粪便产量显著降低 (P< 0.001)。治疗14 d后,对照和阿莫西林治疗组按体重调整的粪便产量相似 (ESI图S7)。当粪便排泄量与14 d进食时间点的食物摄入量相匹配时,三种处理的大鼠的粪便排泄量相似 (ESI图S8)。1.2盲肠、结肠和粪便微生物盲肠中定量的双歧杆菌属、乳酸杆菌属和总菌数如图1所示。两种抗生素(阿莫西林和抗生素合剂)处理后7 d和14 d大鼠盲肠双歧杆菌数量均显著减少(P<0.001)。与7 d处理相比,双歧杆菌数量进一步减少在使用抗生素混合物治疗14 d的大鼠中发现 (P<0.001)。用阿莫西林处理的大鼠盲肠乳酸菌数量高于用阿莫西林处理的大鼠抗生素混合物 (P=0.002)。阿莫西林治疗组大鼠盲肠总细菌数与对照组相近。然而,治疗用混合抗生素显著降低了总菌数 (P<0.001)。用抗生素混合物处理14 d的大鼠的总细菌数最低其他任何时间点的治疗 (P=0.007)。

图1 用阿莫西林或抗生素混合物诱导肠道菌群失调的大鼠盲肠细菌。平均值为每克 (g) 盲肠内容物log 10菌落形成单位 (CFU)。误差线表示均值的标准误差。不同字母的平均值差异有统计学意义 (P < 0.05)。
在大鼠结肠中,抗生素治疗(阿莫西林和抗生素混合物)显著减少了双歧杆菌的数量(图2)。用抗生素混合物治疗14 d的大鼠,双歧杆菌数量明显减少。与治疗7 d的大鼠比较,差异有统计学意义 (P=0.026)。在双歧杆菌中没有显著的处理×日互作效应 (P=0.460)。对乳杆菌属有明显的治疗效果 (P=0.003)。乳杆菌属不存在日效应和处理×日互作效应。细菌总数差异无统计学意义 (P >0.05)。

图2 用阿莫西林或抗生素混合物以诱导肠道菌群失调的大鼠结肠细菌。平均值为每克 (g) 结肠内容物log 10菌落形成单位 (CFU)。误差线表示均值的标准误差。不同字母的平均值差异有统计学意义 (P < 0.05)。
大鼠粪便中双歧杆菌、乳酸菌和总菌数量如图3所示。7 d和14 d后,抗生素处理(阿莫西林和抗生素混合物)显著降低了粪便双歧杆菌数量(P =0.040)。与对照组相比,阿莫西林或抗生素混合物处理组大鼠的粪便双歧杆菌数量显著减少 (P<0.001)。无论处理方式如何,7 d后的双歧杆菌数量均显著高于14 d时的数量 (P=0.014)。乳酸菌属受处理显著影响;抗生素合剂组与阿莫西林组比较差异无统计学意义 (P=0.003),但不存在每日与治疗×日交互作用 (P>0.05)。与其他处理(阿莫西林和对照组)相比,抗生素混合处理显著降低了粪便总细菌数 (P<0.001)。特别是,与其他处理相比,抗生素混合物处理的大鼠在7和14 d后的总细菌数最低(P=0.009)。经阿莫西林处理的大鼠粪便总细菌数与对照组比较差异无统计学意义(P>0.05),对粪便总细菌数无日效应 (P>0.05)。

图3 用阿莫西林或抗生素混合物以诱导肠道菌群失调的大鼠粪便细菌。平均值是每克 (g) 粪便 log 10 菌落形成单位(CFU)。误差线表示均值的标准差。具有不同字母的平均值差异显着(P< 0.05)。1.3盲肠、结肠和粪便有机酸用抗生素治疗的大鼠盲肠中的乙酸含量较低与阿莫西林组和对照组比较,差异有显著性(P<0.001) (表1)。抗菌素 (阿莫西林和抗生素混合物) 组大鼠盲肠内丁酸、异丁酸、戊酸和异戊酸含量显著低于对照组 (P<0.05),盲肠内未检测到这些酸。服用抗生素(阿莫西林和抗生素混合物)的大鼠在两个时间点的丙酸浓度均低于对照组 (P<0.001),但14 d后浓度显著高于对照组 (P<0.05)。7 d后测值比较差异有统计学意义 (P=0.018)。与对照组比较,阿莫西林组琥珀酸浓度升高,混合抗生素组琥珀酸浓度降低,差异有统计学意义 (P<0.001)。甲酸和乳酸浓度在三个处理间差异不显著 (P>0.05)。表1 阿莫西林或抗生素混合物致肠道菌群失调大鼠盲肠有机酸

在结肠中,对照组的乙酸浓度显著高于阿莫西林组(P<0.001)(表2)。对照组大鼠有一定浓度的丁酸,而阿莫西林和抗生素混合物组大鼠未检测到丁酸 (P<0.001)。7 d后对照组甲酸水平高于其他处理组 (P=0.077)。丙酸、琥珀酸和戊酸浓度的处理效果显著 (P<0.001)。与阿莫西林和抗生素混合物组相比,对照组大鼠的丙酸和戊酸含量较高,而阿莫西林组的琥珀酸含量比对照组和抗生素混合物组高。表2 阿莫西林或抗生素混合物引起肠道菌群失调的大鼠结肠有机酸

在粪便中,抗生素处理组(阿莫西林和抗生素混合物)的乙酸浓度低于对照组(P<0.001) (表3)。与抗生素处理相比,对照组丁酸和戊酸含量显著升高 (P<0.001)。三个处理间乳酸浓度差异不显著 (P>0.697),只有对照组和阿莫西林处理组在7 d后才能检测到异戊酸 (P=0.05),而对照组和阿莫西林组仅在7 d后检测到异戊酸(P=0.05)。丙酸在对照组和阿莫西林处理组均高于抗生素混合处理组(P<0.001),两组间差异有统计学意义 (P<0.05)。14 d而不是7 d阿莫西林组大鼠琥珀酸浓度高于对照组 (P<0.001)。表3 阿莫西林或抗生素混合物致肠道菌群失调大鼠粪便中有机酸

1.4主成分分析盲肠、结肠和粪便细菌群落的PCA(细菌数量的方差-协方差矩阵,突出了较大的比例变化)表明,二维可解释89%的变异性 (图4)。按照每个样本点旁边所示的处理和处理时间 (7 d或14 d) 对样本进行颜色编辑。主成分(PC)1反映了一般细菌数量。再往右的样本往往含有更多的所有细菌。PC 2代表双歧杆菌属,图表下方的样品往往含有更多的双歧杆菌属。盲肠、结肠和粪便的检测结果似乎密切相关。

图4 阿莫西林或抗生素混合物诱导7 d和 14 d肠道菌群失调的大鼠的盲肠、结肠和粪便中的细菌群落主成分分析(PCA)聚类。Bi - 双歧杆菌属,La - 乳杆菌属,Tb - 总细菌,Ca - 盲肠,Co - 结肠和 Fa - 粪便。有机酸的PCA表明,两个维度占变异性的85% (图5)。PC 1反映了三种处理之间琥珀酸浓度的差异。PC 2反映了对照中较高的乙酸、丁酸和戊酸浓度。丙酸与PC 1和PC 2都有很好的相关性(在抗生素混合组中倾向于低于其他组)。SCFA的不同来源 (盲肠、结肠和粪便) 似乎都遵循相同的模式。

图5 阿莫西林或抗生素混合物诱导7 d和 14 d肠道菌群失调的大鼠的盲肠、结肠和粪便中的有机酸的主成分分析(PCA)聚类。Bi - 双歧杆菌属,La - 乳杆菌属,Tb - 总细菌,Ca - 盲肠,Co - 结肠和 Fa - 粪便。
在治疗14 d后取样的大鼠,与7 d后取样的大鼠相比,肠道长度增加(P<0.001)(图6)。这一时间段反映的是5周大的动物与6周大的动物相比,此时的身体生长更快 (ESI图S3)。与对照组相比,阿莫西林治疗7 d后对肠道长度没有影响。然而,与对照组相比,给予抗生素混合物7 d和14 d的大鼠肠道长度显著缩短(P=0.003) (图6)。

图6 通过阿莫西林或抗生素混合物诱导的大鼠肠道长度(十二指肠至结肠)。肠道长度以厘米 (cm) 表示。误差线表示均值的标准差。具有不同字母的平均值差异显着(P< 0.05)。与对照组相比,抗生素组 (阿莫西林和抗生素混合物) 的盲肠重量显著增加(P<0.001) (图7)。当盲肠重量与总体重进行比较时,这种增加保持不变。与对照组和阿莫西林组相比,注射抗生素混合物14 d的大鼠在7 d和14 d后盲肠较大(P=0.002)。

图 7 阿莫西林或抗生素混合物引起肠道菌群失调的大鼠的盲肠重量。盲肠重量以克 (g) 表示。误差线代表平均值的标准误差。具有不同字母的平均值差异显着(P<0.05)。2 牛奶和羊奶对阿莫西林所致肠道菌群失调的影响2.1 临床评估在研究开始时,两组之间的体重没有显著差异 (ESI表S5)。牛奶、不加抗生素处理(对照组)组大鼠的生长速度明显低于其他组。研究期间的食物摄入量反映了大鼠体重的增加 (ESI表S6)。与其他处理相比,抗生素第4周组的动物在第3周和第4周之间没有增加食物摄入量 (ESI表S7)。第4周给予抗生素治疗的大鼠,牛奶组大鼠的摄入量高于羊奶组 (P=0.047)。在四周的研究中,粪便排泄量也同样增加 (ESI表S8)。然而,在服用抗生素的几周内,这两种奶的产量都出现了下降。这一点在第4周尤为显著,在第4周羊奶(抗生素第4周)和牛奶 (抗生素第4周) 大鼠产生的粪便都比其他实验处理少。这可能反映了这几周食物摄入量的减少,再加上抗生素对肠道微生物区系和生理的影响。试验组之间的肠道长度没有显著差异 (ESI表S9)。牛奶和抗生素对盲肠重量有显著影响 (ESI表S9),其中饲喂羊奶的大鼠盲肠比饲喂牛奶的大鼠重(P=0.005),特别是饲喂羊奶的大鼠,抗生素第4周治疗 (P<0.001)。2.2 盲肠和结肠微生物盲肠内细菌数量如表4所示。类杆菌、普雷沃特氏菌、卟啉单胞菌和肠球菌的数量没有显著差异在老鼠的盲肠里。在对照组 (不加抗生素) 中,用羊奶喂养的大鼠盲肠内的乳酸杆菌数量显著高于对照组 (P<0.001),而乳杆菌的数量显著高于对照组 (P<0.05),和双歧杆菌属是相似的。在接受这两种抗生素治疗的羊奶喂养的动物中,产气荚膜梭菌的数量比相应的接受抗生素治疗的牛奶动物要低。从治疗4周的大鼠身上收集的盲肠样本代表了抗生素治疗一周结束时的细菌数量。虽然牛奶组和羊奶组的产气荚膜梭菌数量都减少了,但食用羊奶动物的双歧杆菌和乳杆菌属在盲肠数量却增加了。从第2周抗生素组收集的样本代表抗生素治疗后2周恢复的盲肠细菌。这些恢复组的动物细菌总数最多,而那些饲喂牛奶的动物毛螺旋菌科更多 (表4)。表4 牛奶和山羊奶对阿莫西林诱导肠道菌群失调大鼠盲肠细菌的影响

在第2周,接受抗生素治疗的大鼠与第4周接受抗生素治疗或不使用抗生素的大鼠相比,结肠产气荚膜梭菌的数量更高 (表5) 。而在第4周用抗生素治疗的大鼠乳杆菌数量较多。比其他实验组的大鼠 (处理过的大鼠在第2周使用抗生素或不使用抗生素) 2周时抗生素组大鼠的细菌总数高于4周时抗生素组大鼠。牛奶、抗生素和牛奶×抗生素互作对大鼠结肠内拟杆菌属-普雷沃特菌属-卟啉单胞菌组、双歧杆菌属、肠球菌属和毛螺杆菌科均无显著影响 (表5)。表5 牛奶和山羊奶对阿莫西林诱导肠道菌群失调大鼠结肠细菌的影响

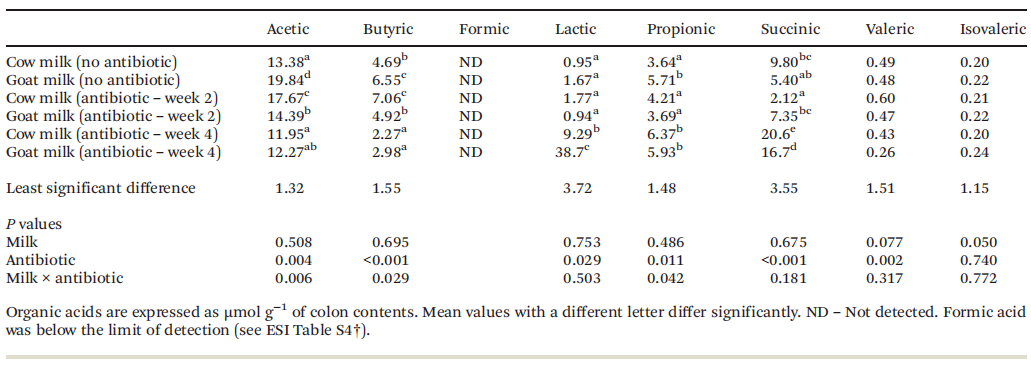
2.3 盲肠和结肠有机酸盲肠中定量的有机酸如表6所示。在羊奶中,动物盲肠中的乙酸浓度最高,不使用抗生素的处理组和在第2周和第4周使用抗生素的动物盲肠中的乙酸浓度分别降低49%和36%。在服用抗生素的大鼠中,两种牛奶的丁酸浓度都在第4周达到最低。饲喂抗生素的大鼠盲肠乳酸浓度在第4周最高,未给予抗生素的羊奶喂养的大鼠盲肠乳酸浓度最高,给抗生素第2周的山羊奶喂养的大鼠盲肠乳酸浓度最低。在第4周使用抗生素时,两种牛奶的琥珀酸浓度都是最高的。表6 牛奶和山羊奶对阿莫西林诱导肠道菌群失调大鼠盲肠有机酸的影响

实验处理对大鼠结肠中有机酸的影响较小(表7)。对于乙酸和丁酸,在抗生素第4周处理时,这两种奶源的浓度都较低。在抗生素第4周的处理中,两种奶源的结肠乳酸和琥珀酸浓度都显著较高。与其他牛奶处理相比,给予抗生素第4周牛奶处理的大鼠的丙酸浓度更高。对于羊奶,抗生素2周处理组大鼠的丙酸浓度较低,对戊酸和异戊酸没有显著影响。甲酸的含量低于最低检出限 (LOD)。表7 牛奶和山羊奶对阿莫西林诱导肠道菌群失调大鼠结肠有机酸的影响
2.4主成分分析细菌群落的主成分分析 (细菌数量的方差-协方差矩阵突出了很大的比例变化) 表明,PC 1将牛奶、抗生素第2周组与盲肠和结肠中的其他组分开(图8)。这似乎是由于盲肠中的产气荚膜梭菌和乳螺科细菌数量较多所致。PC 2是由双歧杆菌属的个体差异引起的。在动物盲肠内放入羊奶,抗生素周4组。

图8 饲喂牛奶和山羊奶的大鼠盲肠(A和B)和结肠(C和D)细菌群落的主成分分析(PCA)。BPP组-拟杆菌-普雷沃氏菌-卟啉单胞菌组。CM - 牛奶和 GM - 山羊奶。有机酸浓度主成分分析通过抗生素处理 (PC 1),然后通过个体动物差异 (PC 2) 分离数据 (图9)。有机酸与主成分的相关性反映了盲肠和结肠(PC 1)中丁酸、琥珀酸和戊酸含量的差异,以及盲肠和结肠(PC 2)中乳酸含量的差异。

图 9 饲喂牛奶和山羊奶的大鼠的盲肠(A和B)和结肠(C和D)中有机酸的主成分分析 (PCA)。CM -牛奶和 GM - 山羊奶。
研究了抗生素对新生断奶大鼠肠道菌群失调的影响。结果表明,阿莫西林和抗生素混用对大鼠体重、摄食量和粪便排泄量有不同程度的影响。抗生素混合物可降低治疗7 d和14 d大鼠的体重、摄食量和粪便排泄量。这些结果与用氨苄青霉素、甲硝唑或庆大霉素组成的抗生素混合物治疗小鼠时体重和排泄量下降的小鼠相似。在目前的研究中服用中谱阿莫西林7 d和14 d的大鼠体重、摄食量和排泄量都较低,但这些差异与对照组相比没有显著差异。早期的研究已经报道了阿莫西林治疗对大鼠摄食量的影响,但研究结果存在差异。阿莫西林治疗10周龄WH大鼠与对照组相比,阿莫西林组大鼠的摄食量明显减少,而给予阿莫西林治疗的SD大鼠 (5日龄) 的摄食量与对照组相比显著增加。这些对比发现可能与大鼠品系和/或年龄的差异有关。虽然其潜在机制尚未被研究,但在本研究中,由广谱氨苄青霉素、庆大霉素和甲硝唑组成的抗生素混合物对大鼠代谢过程的影响似乎比单独使用阿莫西林更大。
阿莫西林和抗生素混合使用对肠道细菌数量和代谢活性有影响。作为对抗生素治疗的反应,在7 d和14 d后,盲肠、结肠和粪便中的细菌数量和有机酸浓度都出现了类似的模式。阿莫西林和抗生素混合处理后,盲肠、结肠和粪便中双歧杆菌数量均有所减少。特别是,抗生素混合处理对双歧杆菌数量有显著影响,14 d后观察到的数量最低。在大鼠中,对抗生素混合物 (氨苄西林和新霉素) 的反应中,双歧杆菌也有类似的减少。
经阿莫西林治疗的大鼠盲肠和结肠中乳酸菌数量较多。阿莫西林是一种中谱抗生素,可以抑制革兰氏阳性和革兰氏阴性微生物的生长。肠道细菌对阿莫西林敏感的体外研究较早有报道,但乳酸菌群中发现了物种依赖性的耐药性。5日龄的SD大鼠经阿莫西林治疗后发生改变。然而,这些差异并没有持续到成年期。在本研究中,用抗生素混合物处理的大鼠盲肠、结肠和粪便中的乳酸杆菌种类较低,这与早期研究的结果一致。此外,抗生素混合物降低了7 d和14 d后的总细菌数量,而阿莫西林和对照之间的总细菌数量保持相似。
在目前的研究中,抗生素治疗对肠道微生物区系代谢的影响是不同的,结果通过测量大鼠盲肠、结肠和粪便中有机酸的浓度来衡量。阿莫西林和抗生素混合物处理后7 d和14 d,大鼠盲肠、结肠和粪便中的短链脂肪酸 (乙酸、丁酸或丙酸) 浓度均降低。特别是在接受这两种抗生素治疗的大鼠中,丁酸浓度被降低到检测范围以下。7 d和14 d后,服用抗生素混合物的大鼠盲肠、结肠或粪便中的琥珀酸浓度降低。相反,与对照组相比,阿莫西林组大鼠的琥珀酸浓度升高,这与早期的一项大鼠研究结果一致。与第7 d和第14 d的样本相比,抗生素混合物处理组在14 d后更大程度地降低了有机酸浓度。肠道中产生的短链脂肪酸在宿主的生理过程中起着至关重要的作用,并在减轻代谢和炎性疾病方面提供有益的效果。本研究中的短链脂肪酸因抗生素治疗而发生的变化可能影响了宿主的生理,这些影响需要进一步的研究。
抗生素混合处理较其他处理更能缩短肠道长度,增加盲肠重量。抗生素混合物对盲肠重量的影响以前也观察到用抗生素混合物处理的小鼠氨苄青霉素,甲硝唑和庆大霉素。这些结果表明,抗生素混合物比单独阿莫西林对实验动物肠道结构的影响更大。
肠道菌群对人类健康至关重要,一个健康的婴儿肠道菌群是一个人未来健康的重要决定因素。抗生素引起的婴儿和儿童早期肠道菌群组成的变化似乎会对以后的生活产生持久的负面影响。婴幼儿通常只使用一种抗生素来治疗细菌感染,所以在研究的第二部分,我们使用了常用的抗生素阿莫西林,来比较饲喂牛奶和羊奶对由此产生的肠道失调的影响。
随后,我们应用阿莫西林诱导断奶大鼠肠道菌群失调,因为阿莫西林是婴幼儿常用的抗生素,能有效改变肠道菌群数量和肠道结构。饲喂牛奶和羊奶的动物在服用抗生素中断后的2周内肠道微生物区系得以恢复。那些饲喂牛奶的动物也增加了盲肠乳螺科的数量。在研究的最后一周 (第4周),牛奶和羊奶似乎可以保护肠道细菌免受抗生素的干扰。尤其是盲肠和结肠的潜在致病性产气荚膜梭菌减少。羊奶组 (第4周) 的双歧杆菌和乳酸菌数量较不添加抗生素时显著增加 (P<0.05)。结果表明,羊奶组的双歧杆菌和乳酸菌数量显著高于对照组 (P<0.01)。
人体内的细菌感染通常用抗生素治疗。然而,它们的使用可能会导致肠道微生物区系的组成和多样性发生变化,进而影响宿主的免疫反应。共生菌还影响与粘膜屏障功能、炎症和营养吸收相关的宿主基因的表达。未来的研究应该探索宿主基因的表达对抗生素和饮食干预的影响。
抗生素可以消除敏感微生物并刺激肠杆菌属、念珠菌属、克雷伯氏菌属、假单胞菌属和梭状芽孢杆菌属微生物定殖的机会,使它们占据以前没有的生态位。在本研究中,我们发现牛奶影响盲肠和结肠中产气荚膜梭菌的数量,喂食羊奶的大鼠的数量往往低于饲喂牛奶的大鼠。在早期的研究中,我们观察到牛奶和羊奶都减少了回肠、盲肠和结肠中的产气荚膜梭菌数量。减少这种机会性病原体是一种有益的反应,因为这种常见的细菌往往与胃肠道疾病有关
在饲喂研究早期 (第2周,恢复) 或在饲喂研究结束 (第4周,保护) 时给予抗生素的效果导致盲肠中细菌总量、双歧杆菌属、产气荚膜梭菌属、乳螺科和乳杆菌属的差异。当研究早期给予抗生素时,喂食牛奶的大鼠盲肠中的细菌总数和乳汁螺科细菌数量都有所增加。相比之下,在喂食羊奶的大鼠中,在研究早期接受抗生素治疗后,唯一受影响的细菌群是乳杆菌科细菌,盲肠中的细菌数量减少了。在研究结束时喂给大鼠抗生素的牛奶中,盲肠和乳杆菌中的产气荚膜梭菌数量减少。结肠的数量增加了。而饲喂羊奶的大鼠,双歧杆菌数量明显减少。盲肠中产气荚膜梭菌增多,产气荚膜梭菌减少。乳杆菌属在盲肠和结肠中都增加了。Shih等人结果表明,混合乳酸菌能恢复抗生素诱导的小鼠肠道微生物区系,且恢复效果优于自然恢复。在同一项研究中,他们还发现用乳酸治疗老鼠与自然恢复相比,细菌减少了病原菌--脱硫弧菌,增加了有益的阿克曼菌属等。在婴儿中,阿莫西林降低了粪便细菌总数,增加了大肠杆菌;而饲粮中添加益生元可显著增加双歧杆菌数量,恢复粪便细菌总数和大肠杆菌数量。双歧杆菌负责牛奶低聚糖的发酵,而低聚糖在羊奶中的含量要高于牛奶。据报道羊奶中含有60-350 mgL−1的低聚糖,低于人奶 (5-20 mgL−1),但高于奶牛奶 (30-60 mgL−1) 和羊奶 (20-40 mgL−1)。研究表明,羊乳寡糖在体外能促进双歧杆菌的生长和代谢。这可能是在饲喂羊奶的大鼠中观察到双歧杆菌数量增加的原因,而饲喂牛奶的大鼠中没有。在目前的研究中,我们量化了关键细菌种群,如双歧杆菌和乳酸菌,因为它们在肠道健康中起着重要作用,通过饮食增加它们的丰度被认为是很重要的健康促进。利用肠道微生物群宏基因组分析进行进一步研究,可以深入了解牛奶和羊奶对微生物群组成和代谢的独特影响。肠道微生物区系失调也通过短链脂肪酸影响宿主免疫和代谢。不可消化碳水化合物 (NDCs) 由产生SCFAs的肠道细菌利用,特别是在宿主生理功能中具有不同作用的乙酸、丁酸和丙酸。除了NDCs外,SCFAs的合成还可以通过氨基酸和乙醇的细菌发酵或代谢途径发生。虽然我们没有研究短链脂肪酸合成的代谢途径,但在当前的研究中,牛奶的来源已经影响了短链脂肪酸的分布,在对照组 (未使用抗生素) 的动物食用羊奶时,总短链脂肪酸的产量要高出60%。对于那些处于恢复期 (抗生素治疗后2周) 的动物,盲肠和结肠SCFAs的相对比例与对照组动物一致,表明牛奶的摄入恢复了肠道微生物群的代谢。在这些动物中,有增加丁酸和乙酸浓度的趋势。在研究结束时,用抗生素处理过的动物的有机酸曲线反映了非生物状态,SCFAs (乙酸和丁酸) 的比例减少,琥珀酸的比例增加。在早期的一项大鼠研究和本研究中,在建立抗生素诱导的失调大鼠模型时,也报道了给阿莫西林后琥珀酸浓度增加。琥珀酸是一种中间代谢物,由肠道微生物群成员使用,在肠道中通常以低浓度检测。第4周抗生素组琥珀酸浓度表明阿莫西林治疗扰乱了肠道自然菌群组成和代谢。另一方面,肠道中的乳酸浓度受到细菌产生、随后的利用和宿主吸收的影响。一些细菌通过代谢交叉喂养利用乳酸生产丁酸和丙酸。在第4周接受抗生素治疗后,食用羊奶的动物的盲肠和结肠中短链脂肪酸的浓度都增加了,乳酸是有机酸池的主要贡献者。这可能反映了在这些动物中检测到的乳酸菌、乳酸菌和双歧杆菌的数量增加。
在阿莫西林诱导的肠道菌群失调大鼠中,羊奶能有效增加双歧杆菌和乳酸杆菌的数量,同时降低产气荚膜梭菌的数量。牛奶增加了乳酸菌的数量,减少了产气荚膜梭菌的数量。奶牛和羊奶喂养的大鼠的微生物代谢变化差异表现在盲肠和结肠SCFAs(醋酸,丁酸和丙酸)浓度。总的来说,这些结果表明,在抗生素诱导的大鼠肠道失调后,羊奶和牛奶在改变未成熟肠道微生物群组成和代谢方面存在差异。
